Прениллипиды
Значительное место среди биохимических компонентов пластид растений занимают прениллипиды, которые играют важную структурную и функциональную роль в организации мембран и других образований. Прениллипиды пластид представлены двумя группами органических веществ.
Простые прениллипиды состоят только из изопреноидных соединений (например, каротиноиды), тогда как в смешанных боковая изопреноидная цепь связана с нетерпенодным ядром (пренилхиноны, хлорофилл). В изолированных хромопластах, а также в различных субфракциях этих органелл обнаружены следующие прениллипиды:
- каротиноиды;
- 'alpha;-токоферол;
- пластохинон-9;
- пластогидрохинон;
- 'alpha;-токохинон;
- филлохинон (витамин K1).
Структуры основных прениллипидов хромопластов представлены на рис. 1. 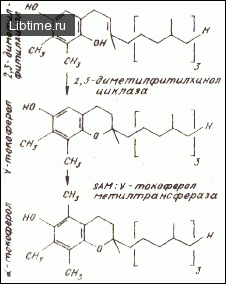
В процессе трансформации хлоропластов в хромопласты происходят значительные изменения в количественном содержании пренилли-пидных соединений.
Так, содержание пластохинона-9 и 'alpha;-токоферола в хромопластах плодов перца однолетнего было значительно выше, чем в хлоропластах, что согласуется также с данными, полученными H.Lichtenthaler, которые свидетельствуют об увеличении содержания 'alpha;-токоферола в процессе созревания этого растения.
Филлохинон, (витамин K1), согласно современным представлениям, играет важную роль в процессе фотосинтеза и располагается в хлоропластах зеленых плодов. Однако пластиды красных плодов не содержат этого компонента в заметных количествах. 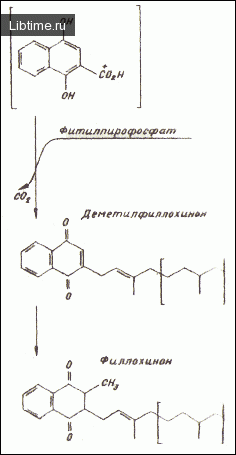
В то же время филлохинон был обнаружен в пластоглобулах сформированных хромопластов цветков саротамнуса метлистого. Однако наиболее существенным изменениям в процессе трансформации хлоропластов в хромопласты подвергаются пигменты, особенно хлорофилл, полностью исчезающий в развитых хромопластах. а-токоферол в настоящее время рассматривается как соединение, предотвращающее окисление мембранных липидов, а следовательно, задерживающее старение клеток.
Это особенно важно для хромопластов, характеризующихся высоким содержанием полиненасыщенных липидов. Было показано, что в процессе превращения хлоропластов в хромопласты содержание 'alpha;-токоферола в мембранной фракции хромопластов увеличивается более чем в 4 раза. При этом 'alpha;-токоферол отсутствовал в строме органелл и был обнаружен в высокоочищенных пластоглобулах хромопластов саротамнуса метлистого.
Исследованиями на растительных тканях было установлено, что 'alpha;-токоферол образуется из 2,3-диметил-фитилхинола через токоферол как промежуточное соединение (рис. 1). Когда изолированные хромопласты инкубировали в присутствии меченого S-аденозил-[метил-14 С] -метионииа и диметилфитилхинона, образовывался 'alpha;-токоферол, что указывало на способность исследуемых органелл осуществлять последние этапы синтеза этого соединения.
При этом активность хромопластов в отношении синтеза 'alpha;-токоферола (0,06 пико-моль в мин на 1 мг белка) была значительно выше по сравнению с активностью хлоропластов шпината.
Хромопласты являются также местом синтеза филлохинона (рис. 2). Было показано, что изолированные пластиды зеленых и зрелых плодов перца однолетнего способны включать метку 8-аденозил-[метил-14С]-метионина. Опыты с фитилпирофосфатом, а-нафтохиноном, дигидро-а-нафто-хиноном, 1,4-диокси-2-нафтиловой кислотой и деметилфиллохиноном показали, что эти вещества могут быть предшественниками в синтезе филлохинона.
Кроме того, было установлено, что ферменты, принимающие участие в синтезе витамина K1 (1,4-диокси-2-нафтоат пренилтрансфераза и S-аденозил-метионин метилтрансфераза), локализованы в мембранах хромопластов и хлоропластов. 
Известно, что фитилпирофосфат и другие терпеноидные боковые цепи прениллипидов образуются из геранилгеранилпирофосфата (ГГПФ). ГГПФ, как было показано, синтезируется в хромопластах. Хлоропласта фотосинтезирующих тканей синтезируют фитилпирофосфат и другие боковые цепи смешанных прениллипидов из ГГПФ. По-видимому, хромопласты также могут осуществлять эти реакции, однако место синтеза нетерпеноидных ядер пока не установлено.