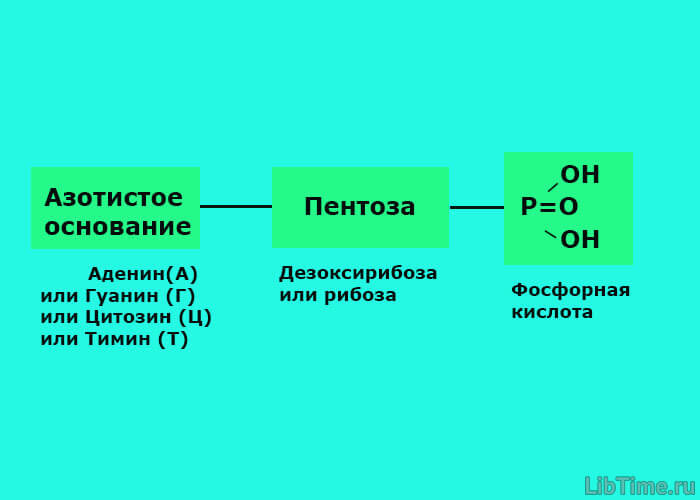
Выделение хромопластной ДНК
Для изучения физико-химических характеристик используется высокоочищенная ДНК. Однако вещества вторичного происхождения (фенольные соединения, полисахариды и др.) активные нуклеазы затрудняют ее выделение. Следует также иметь в виду, что методы выделения чистых препаратов ДНК, применяемые для одного объекта, для других не дают положительных результатов.
Это подтвердилось нашими опытами по очистке ДНК из пластид корнеплодов и листьев моркови. Использование различных модификаций фенол-хлороформ-детергентного метода, фракционирование на колонках с оксиапатитом, а также применение цетавлона не давало положительных результатов.
Полученные при этом препараты ДНК не отвечали требованиям, предъявляемым к чистым нативным ДНК. Отмечалось загрязнение белками и полисахаридами и низкий гиперхромный эффект ДНК (табл. 1).
Чистота и нативность препаратов улучшались при комбинировании определенных этапов различных методов. Использование фенол-хлороформ-детергентной депротеинизации, с хроматографией на оксиапатите позволило нам получать препараты пластидных ДНК, хорошо очищенных от белков (А260/А230 = 1,8-1,85) и полисахаридов (А260/А230 = 1,95-2,05) и обладающих высоким уровнем нативности (гиперхромный эффект находился в пределах 33-38 %) независимо от вида исследуемых растений.
Таблица 1. Характеристика препаратов ДНК хромопластов корнеплодов красной моркови сорта Харьковская Нантская, выделенных при использовании различных методик
| Методика | А260/A230 | А260/A280 | Гиперхромных эффект, % |
| В. П. Лобов и др. | 1,4 | 1,6 | 20 |
| Ю. М. Сиволап, А. Н. Котлов | 1,4 | 1,6 | 21 |
| Г. Е. Сулимов, А. Г. Слюсаренко | 1,6 | 1,3 | 18-22 |
| R. Kolonder, K.Tewari | 1,6 | 1,8 | 20 |
| R. Britten et al. | 1,4 | 1,7 | 26 |
| Г. Е. Сулимова и др. | 2,0 | 1,4-1,6 | 22-25 |
| В. П. Лобов, И. А. Петров | 1,95-2,05 | 1,8-1,85 | 33-38 |
Важным моментом при получении очищенных препаратов пластидных ДНК является устранение примесей ядерных ДНК. В среднем в одном ядре содержится столько же ДНК, сколько ее имеется в тысяче пластид. Следовательно, даже незаметные загрязнения препаратов хлоро-, хромопластов или других пластид ядерными фрагментами может влиять на результаты изучения физико-химических характеристик пластидных ДНК.
С целью устранения возможных примесей ядерных ДНК используется инкубация пластид в присутствии нуклеаз. R.Herrmann с соавт. показал, что сочетание обработок ДНКазой и фосфодиэстеразой полностью устраняет примеси ядерной ДНК в препаратах пластид практически из любого растения. Смысл нуклеазной обработки заключается в том, что ДНКаза и фосфоди-эстераза легко проникают через интактную ядерную оболочку, но внутрь интактных пластид не проникают.
При нуклеазной обработке разрушаются все ядерные ДНК, а также ДНК органелл с поврежденными мембранами оболочки, в то время как ДНК интактных пластид остается в нативном состоянии. Имеется еще один путь избавления от ядерных примесей. H.Bohnert, E.Crouse, изучая условия для получения очищенных препаратов хлоропластной ДНК, установили, что многократное промывание пластид в буфере, содержащем ЭДТА, также эффективно в удалении ядер и их фрагментов.
При получении препаратов ДНК из пластид корнеплодов и листьев моркови В. П. Лобов и И. А. Петров использовали как нуклеазную обработку, так и промывание органелл в среде, содержащей ЭДТА. Надежным критерием чистоты пластидных ДНК является их способность к быстрой ренатурации.
Пластидные ДНК, характеризующиеся незначительной по сравнению с ядерной ДНК кинетической сложностью, быстро реассоциируют после денатурации, тогда как денатурированная ядерная ДНК реассоциирует продолжительное время. Полученные В. П. Лобовым и И. А. Петровым препараты пластидных ДНК моркови через 120 мин реассоциировали до исходного поглощения при длине волны 260 нм (рис. 1).
Это свидетельствовало об отсутствии ядерных загрязнений в препаратах пластидных ДНК, что позволило использовать их в изучении тепловой денатурации и кинетики ре-ассоциации. 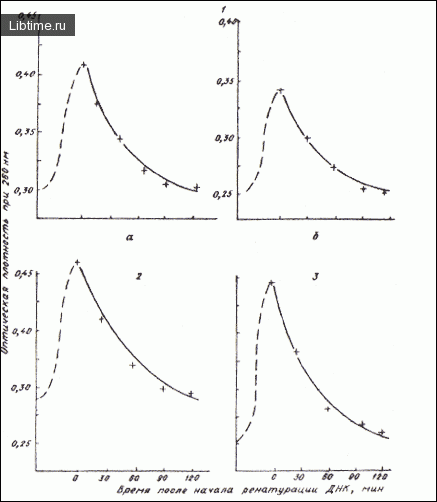
Последовательные этапы разработанного В. П. Лобовым и И. А. Петровым метода выделения ДНК из хромопластов корнеплодов красной моркови сорта Харьковская Нантская, а также хромопластов желтой моркови сорта Мшак, амилопластов белой моркови сорта Белая зеленоголовая и хлоропластов листьев указанных сортов моркови, описаны ниже.
Фракцию изолированных пластид суспендировали в среде для выделения (0,05 М трис, 0,5 М маннит, 0,03 М аскорбино вая кислота, 0,01 М ЭДТА; 0,1 %-ный бычий сывороточный альбумин, рН среды 7,8-7,9), содержащей 10 мМ хлористого магния, добавляли ДНКазу из расчета 100 мкг/мл и инкубировали 30 мин при 0 - +4 °С, постоянно перемешивая суспензию.
Затем добавляли фосфодиэстеразу змеиного яда га расчета 30 мкг/мл и инкубацию продолжали еще 20 мин. Для прекращения действия нуклеаз добавляли трехкратный объем раствора щелочного ЭДТА (0,15 М NaOH, 01 М ЭДТА, рН 8,0) и обработанные таким образом пластиды осаждали центрифугированием 30 мин при 2500 об/мин. Осадок пластид лизировали в 10-кратном объеме щелочного ЭДТА, содержащем 3 % додецилсульфата натрия.
Лизат экстрагировали равными объемами водонасыщенного фенола, рН 8,0, смесью фенол:хлороформ (4:1), а также эфиром - дважды в каждом случае. Затем нижнюю фазу диализовали в течение ночи против 0,24 М натрий-фосфатного буфера рН 6,8, обрабатывали 4 ч проназой (50 мкг/мл), доводили до 8 М мочевиной и 1 М NaCl и очищали на колонке с оксиапатитом. Для этого полученный раствор ДНК пропускали через колонку с оксиапатитом, предварительно уравновешенным раствором, содержащим 0,18 М натрий-фосфатного буфера, 1 М NaCl и 8 М мочевины.
Этим же раствором промывали колонку до исключения поглощения эллюента при 260 нм. В процессе указанных процедур ДНК адсорбируется на оксиапатите, тогда как загрязняющие вещества не задерживаются на колонке. Затем колонку промывали 0,10 М натрий-фосфатным буфером с целью удаления мочевины и ДНК смывали 0,4 М натрий-фосфатным буфером. R.Herrmann применял при выделении ДНК из органелл нарцисса желтого следующие процедуры.
Органеллы суспендировались в 2 объемах 0,3 М NaCl 0,03 М трис, рН 8,7 (или 0,3 М NaCl, 0,03 М цитрат натрия, рН 8,0) и лизировались 10 мин при комнатной температуре додецилсульфатом натрия (5 %). Смесь осторожно встряхивали с равным объемом хлороформа с октанолом (6:1) и центрифугировали 15 мин при 8000 g. Водный слой и интерфазу объединяли, осторожно перемешивали с фенолом, насыщенным 0,03 М трис, рН 8,7, содержащим 5 капель 32%-ного NaOH на 100 мл фенола и центрифугировали 20 мин при 10 000 g.
Фенольную обработку и центрифугирование повторяли. Водная фаза и интерфаза дважды экстрагировалась эфиром и диализовалась при 2 °С против 0,4- (0,15 М NaCl, 0,015 М цитрат натрия, рН 8,0) в течение ночи. Затем растворы обрабатывались 40 мкг/мл свободной от ДНКазы РНКазой А и 200 единиц/мл РНКазы T1 90 мин при 37 °С.
После этого проводили обработку свободной от ДНКазы проназой с добавлением 0,15 % додецилсульфата натрия 4 ч при 40 °С. Ферменты удаляли фенольной депрогеинизацией, а водную фазу диализовали против соответствующего буфера и подвергали дальнейшей очистке в градиенте плотности хлористого цезия. Для этого доводили раствор ДНК до плотности 1,710 г/см3.
Центрифугирование проводили в 5 мл пробирках в бакет-роторе при 33 000 об/мин 68 ч при 20 °С. Градиент раскапывали, ДНК-содержащие фракции собирали, диализовали против 0,3* (0,15 М NaCl, 0,015 М цитрат натрия) и использовали для изучения физико-химических свойств.
При выделении кольцевых молекул из хромопластов нарцисса желтого и тюльпана использовался метод, примененный ранее для идентификации кольцевых молекул в хлоропластах шпината. К 2 мл суспензии очищенных пластид добавляли 2 мл раствора, содержащего 0,79 М сахарозы, 0,15. М NaCl, 0,1 М ЭДТА, SO мМ трис-HCl, рН 9,0, а также доде-цилсульфат натрия (до конечной концентрации 0,5%)., проназу (1 мг/мл) и дезоксихолат натрия (1 %).
При инкубации смесь перемешивали при 4 °С с последующим постоянным добавлением пяти-молярного перхлората натрия до конечной концентрации 1 М и выдерживали 30 мин при 4 °С с 0,5 объема хлороформ: изоамиловый спирт (24:1) и 1 объемом фенола насыщенного 0,15 М NaCl, 0,1 М ЭДТА, 50 мМ трис, рН 9,0. Смесь центрифугировали при 1000g 15 мин при 4 °С.
Водная фаза удалялась и диализовалась в течение ночи против 0,15 М NaCl, 0,015 М цитрат натрия, 0,5 мМ ЭДТА, рН 8,0, на холоду. После этих операций ДНК была готова для электронно-микроскопических исследований. Существенным моментом в описанной методике является использование проназы, которая разрушает белки, освобождая интактные молекулы ДНК.
Однако это возможно только в случае отсутствия примесей ДИКазы в препаратах фермента. J J.Thompson , изучая физико-химические характеристики ДНКаз, для выделения хромопластов настурции большой использовал метод R.Ko-lodner, K.Tewari , разработанный для хлоропластов высших растений.
Согласно этой методике пластидная фракция после обработки ДНКазой и промывки ЭДТА осаждалась, затем ресуспендировалась в 4,8 мл буфера А, содержащего 0,05 М трис, 0,002 М ЭДТА, рН 8,0, проназу (200 мкг/мл).
К суспензии добавляли 1,2 мл 10 %-ного саркозила натрия в том же растворе и смесь инкубировали 30 мин при 37 °С в стеклянной центрифужной пробирке. Затем добавляли 2 мл буфера А, содержащего 4 М хлористого цезия, и пробирки помещали на лед в течение 90 мин.
Смесь центрифугировали 30 мин при 1200 g на холоду (4 °С) и супернатант переносили в нитроцеллюлозные пробирки, которые предварительно вымачивали в течение ночи в 10 %-ном саркозиле натрия. В каждую центрифужную пробирку добавляли 3,2 г хлористого цезия и 0,2 мл раствора бромистого этидия (10 мкг/мл).
Каждая пробирка подслаивалась 3 мл подушкой, содержащей хлористый цезий (р =1,74), 0,05 М трис, 0,01 М ЭДТА, 200 мкг/мл бромистого этидия, рН 8,0, и пробирки центрифугировались 12-16 ч в Spinco SW = т 41 роторе при 25 000 об/мин. После остановки центрифуги пробирки исследовались под длинноволновым ультрафиолетовым светом β65 нм) и флуоресцирующие полосы ДНК отбирались.
Пластидные ДНК с шести градиентов объединялись и помещались в обработанных саркозилом натрия нитроцеллюлоэных пробирках^Затем растворы ДНК разбавляли 5 мл раствора, содержащего хлористый цезий (р = 1,57), 0,05 М трис, 0,01 М ЭДТА, 200 мкг/мл бромистого этидия, рН 8,0; и ДНК повторно центрифугировалась 30-48 ч в Spinco SW = 41 роторе при 32 000 об/мин.
Этидий бромистый из ДНК-содержащей фракции градиента удалялся экстракцией изопентиловым спиртом, насыщенным 0,01 М ЭДТА, а ДНК диализовалось против трех смен 0,1 М NaCl 0,05 М трис, 0,01 М ЭДТА, рН 8,0 (500 мл). Использование этого метода для выделения ДНК из хромопластов лепестков настурции большой позволило J.Thompson получить препараты, состоящие из 52 % кольцевых и 48 % линейных молекул.
В целом выбор метода выделения ДНК зависит от цели эксперимента. При изучении тепловой денатурации и кинетики ре-ассоциации, например, где необходимы высокая степень чистоты, но используется фрагментированная ДНК, лучше использовать методы, не требующие ультрацентрифугирования.
При выделении ДНК для электронно-микроскопических исследований и рестрикционного анализа чаще используют центрифугирование в градиенте плотности хлористого цезия и мягкие условия лизиса органелл во избежание фрагментации ДНК под действием механических факторов.
Продолжение: Размер и конформация ДНК.