Биосинтез каротиноидов
Исследования биосинтеза каротиноидов установили наличие универсального пути у высших растений, водорослей, бактерий и грибов через общие предшественники всех терпеноидных соединений - мевалоновую кислоту и изопентенилпирофосфат.
Биосинтез каротиноидов можно разделить на несколько этпаов. Первым из них является образование мевалоновой кислоты из ацетил-кофермента А (рис. 1). Последовательность реакций, ведущих от ацетил-КоА к мевалоновой кислоте, хорошо изучена на животных организмах (как отмечалось ранее, животные сами не могут синтезировать каротиноиды, однако они синтезируют мевалоновую кислоту, которая используется как предшественник в синтезе других соединений, в частности стеролов).
До настоящего времени не исследовались ферменты растений, включенные в синтез 'beta;-окси-'beta;-метил-глютарил-КоА (ОМГ-КоА): ацетоацетил-КоА-тиолаза и ОМГ-КоА-синтаза. Однако имеются сообщения, что хлоропласты высших растений , а также хромопласты зрелых плодов перца однолетнего содержат фермент ОМГ-КоА-редуктазу, который способен превращать ОМГ-КоА в мевалоновую кислоту.
Интересные исследования провели K.Grumbach и B.Forn . Они инкубировали функционально активные пластиды шпината с несколькими субстратами: CO2, уксусной, пировиноградной, фосфоенолпировиноградной, 3-фосфоглицериновой и мевалоновой кислотами. Все они поглощались пластидами и все, за исключением фосфоенолнировилоградной кислоты, включались в 'beta;-каротин.
Хотя точный путь образования ацетил-КоА из фотосинтетически фиксированного углекислого газа не выяснен, анализ кинетики включения субстратов показал, что ацетил-КоА образуется непосредственно из промежуточных продуктов редуктивного пентозофосфатного цикла (из фосфоглицериновой и пировиноградной кислот) как предшественников, а затем используется либо для синтеза жирных кислот либо для образования мевалоновой кислоты. 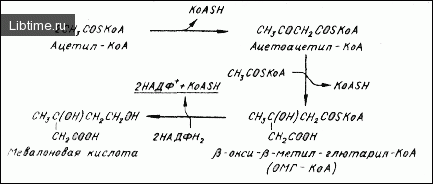
Такие исследования не проводились на изолированных хромопластах. Однако следует отметить, что хромопласты цветков нарцисса желтого, способные синтезировать каротиноиды из изопентенилпирофосфата , содержат все ферменты, необходимые для превращения углекислого газа, уксусной кислоты, 3-фосфоглицерина и т.д. в ацилированные липиды .
Эти результаты вместе с данными о том, что изолированные хромопласты перца однолетнего способны превращать ОМГ-КоА в мевалоновую кислоту, позволяют заключить, что на первом этапе синтеза каротиноидов происходит образование мевалоновой кислоты из ацетил-КоА, как показано на рис. 1. 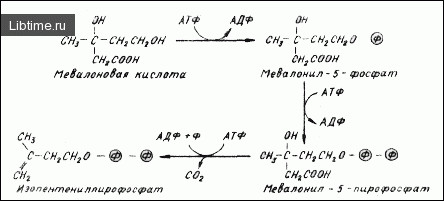
Однако следует принимать во внимание и возможность поступления и хромопласты мевалоновой кислоты, синтезированной в цитоплазме клеток. Показано, что в процессе трансформации хлоропластов перца однолетнего в хромопласты мембраны оболочек пластид приобретают способность пропускать это вещество.
Способность постепенно возрастает, достигая максимума при соотношении каротиноидов и хлорофилла, равного 1,66, после чего наблюдалось некоторое снижение проницаемости мембран мевалоновой кислотой. Но даже в полностью сформированных хромопластах она сохранялась на довольно высоком уровне.
Следующий этап в синтезе каротиноидов - превращение мевалоновой кислоты в изопентенилпирофосфат (рис. 2). В первой реакции участвует фермент мевалонаткяназа. Превращение мевалонил-5-фосфата в мевалонил-5-пирофосфат осуществлялось в присутствии мевалонил-5-фосфокиназы. Наличие указанных ферментов и катализируемых ими реакций отмечалось для многих растений и микроорга низмов .
Они были продемонстрированы и в опытах с изолированными хромопластами перца однолетнего. Мевалонат-5-пирофосфоангидраза, которая участвует в реакциях образования изопентенилпирофосфата, была очищена из дрожжей и латекса гевеи. В то же время сам изопентенилпирофосфат был обнаружен во всех исследованных объектах. Более того, было показано, что он превращается в каротиноиды в препаратах хлоропластов и хромопластов растений.
На этапе превращения изопентенилпирофосфата в геранилгеранилпиро фосфат с последующим образованием фитоина происходит изомеризация изопентенилпирофосфата (ИПФ) до диметилаллилпирофосфата (ДМАПФ), после чего следуют пренилтраноферазные реакции, ведущие через геранил- и фарнезилпирофосфаты до геранилгеранилпирофосфата.
Доказательства присутствия изопентенилпирофосфат-изомеразы (ИПФ изомеразы) в хромопластах получены при изучении пластид томатов, а в плодах тыквы было обнаружено два изофермента ИПФ-изомеразы . В литературе отсутствуют сведения о включении ДМАПФ в каротиноиды, однако ингибирование превращения мевалоновой кислоты в каротиноиды иодацетамидом свидетельствует, что ДМАПФ является промежуточным продуктом в синтезе каротиноидов. 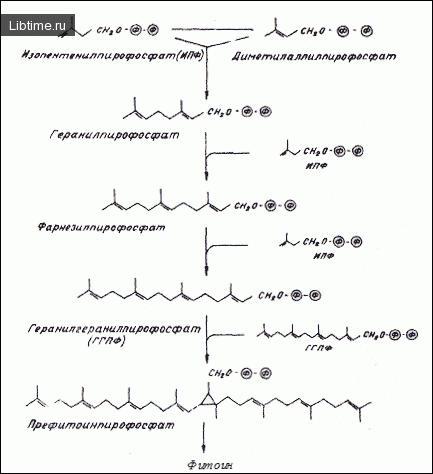
Способность геранилпирофосфата превращаться в каротиноиды была продемонстрирована на препаратах многих высших растений, в том числе на пластидах корнеплодов моркови и плодов томатов. Свободный гераниол также включался в 'beta;-каротин высечками из корнеплодов моркови, по-видимому, в результате присутствия ферментов, способных фос форилировать гераниол.
Было также показано, что пластидные системы корнеплодов моркови и плодов томатов способны включать фарнезил-пирофосфат в 'beta;-каротин. В дальнейшем происходит объединение двух молекул геранилгеранил-пирофосфата (ГГПФ) с образованием префитоинпирофосфата, дефосфорилирование которого ведет к образованию первого С40-каротиноида (рис. 3).
Эксперименты по включению изолированными хромопластами перца однолетнего радиоактивного изопентенилпирофосфата показали, что первым синтезированным С40-соединением является фитоин. Сходные результаты получены и при изучении хромопластов желтого нарцисса. В изолированных хромопластах перца однолетнего фитоин представлен в виде транс-(0,2 %) и цис-(99,1 %) изомеров.
Более того, опыты, выполненные с плодами перца однолетнего in vivo, показали, что заметное количество меченой мевалоновой кислоты включается только в цис-фитоин. Эти данные ясно показывают, что цис-фитоин - первый каротиноид, синтезируемый в хромопластах. В хромопластах, как и в тканях высших растений в целом, первым С40-соединением является цис-изомер, хотя известно, что в некоторых микроорганизмах первым синтезированным каротиноидом является транс-изомер фитоина.
Из ацетоновых порошков пластид томатов был выделен белковый комплекс, способный превращать изопентенилпирофосфат в фитоин. Этот комплекс очищался фракционированием сульфата аммония и на колонке с биогелем А без потери составляющих активностей (ИПФ-изомеразы, пренилтраисферазы, фитоинсинтетазы). Его молекулярная масса 166 000 или 200 000 .
Комплекс активен в присутствии ионов марганца и его активность в 6-7 раз увеличивалась в присутствии АТФ. Функция АТ-5 в стимулировании активности не ясна, поскольку АТФ не включается непосредственно в реакции, происходящие при превращении изопентенилпирофосфата в фитоин. Возможно, АТФ принимает участие в стабилизации комплекса или действует как аллостерический регулятор ферментной активности.
Фитоин-синтетазный комплекс
Фитоин-синтетазный комплекс очень нестабилен. При обычных ионных методах очистки белков на ДЭАЭ-целлюлозе он полностью терял способность синтезировать фитоин, хотя при этом сохранялась ИПФ-изомеразная и пренилтрансферазная активности. Более того, в процессе фракционирования на ДЭАЭ-целлюлозе происходила диссоциация комплекса на несколько компонентов.
При очистке ИПФ-изомеразы из ацетоновых порошков пластид томатов в 245 раз использовали многоэтапный способ с последовательным фракционированием сульфатом аммония, гель-фильтрацией на биогеле А 1.5 М, ионообменной хроматографией на ДЭАЭ-целлюлозе, гель-фильтрацией на сефадексе Г-100 и хроматофокусированием.
Очищенный фермент был стабилен несколько недель в 0,1 М калий-фосфатном буфере, рН 7,0, со держащем 2 мМ дитиотреитола. По свойствам ИПФ-изомераза пластид плодов томатов сходна с ИПФ-изомеразами из других источников (дрожжи, печень свиньи, плоды тыквы). Фермент очень чувствителен к присутствию иодацетамида (полностью инактивируется последним в концентрации 1 мМ).
Вместе с тем ИПФ-изомераза пластид томатов ингибируется промежуточными продуктами синтеза каротиноидов диметилаллил- и геранилпирофосфатами, в то время как фарнезилпирофосфат не оказывал существенного влияния на активность этого фермента. Молекулярная масса ИПФ-изомеразы пластид плодов томатов 34 000 Д. Это значительно ниже аналогичного значения для фермента печени свиньи (82 500 Д).
Характерна ли небольшая молекулярная масса для сходных ферментов других растений - неизвестно, так как до настоящего времени не было сообщений о характеристике ИПФ-изомераз из других растительных объектов. Единственным кофактором, необходимым для функционирования фермента, были ионы двухвалентных металлов (Mn2+ или Mg2+), причем в вариантах опыта, в которых одновременно присутствовали оба элемента, отмечалась максимальная активность ИПФ-изомеразы.
Ионы двухвалентных металлов также необходимы для активации пренилтрансферазы. Однако последняя лишь незначительно ингибировалась иодацетамидом в концентрации 10 мМ, тогда как для полного ингибирования ИИФ-изомеразы достаточно в 10 раз меньше этого реагента. Следует отметить, что пренилтрансферазы из других источников менее чувствительны, чем ИПФ-изомеразы и к сульфгидрильным реагентам.
Молекулярная масса пренилтрансферазы пластид плодов томатов (дашгые хроматографии на сефадексе Г-100) 64 000 Д, что несколько ниже, чем соответствующее значение для аналогичных ферментов из дрожжей, печени свиньи, гороха. Пренилтрансфераза пластид плодов томатов катализировала следующие реакции конденсации: изопентенилпирофосфат + диметилаллилпиро-фосфат, изопентенилпирофосфат + фарнезилпирофосфат, изопентенилпирофосфат + геранилпирофосфат.
Эти три активности элюировались с колонки как один пик. Хроматографический анализ продуктов, полученных в результате реакций, катализируемых пренилтрансферазной фракцией, показал, что один из новообразованных компонентов ведет себя как префитоиновый спирт. Это предполагает, что фермент, который катализирует образование префитоинфосфата, также представлен в пренилтрансферазной фракции.
Однако такой вывод пока что не может быть однозначным, поскольку электрофоретический анализ пренилтрансферазной фракции в присутствии додецилсульфата натрия обнаружил значительную гетерогенность препарата. Достоверные данные могут быть получены лишь при работе с абсолютно чистым ферментом. Фитоин-синтетазный комплекс имеет молекулярную массу 166 000 или 200 000 Д. ИПФ-изомераза и пренилтрансфераза вместе составляют приблизительно 100 000 Д.
Остается фракция 66 000 - 100 000 Д. Вероятно, она отвечает за образование фитоина. Фитоин - бесцветное соединение. Его превращение в окрашенные каротиноиды сопровождается увеличением размера сопряженного полиенового хромофора посредством серии реакций десатурации в каждой из которых удаляется по два атома водорода и вводится двойная связь.
В опытах, выполненных на хромо-, хлоропластах и тканях высших растений, установлено, что промежуточными соединениями в цепи реакций десатурации являются фитофлуин, J-каротин, нейроспорин и конечный продукт ликопин. Реакции десатурации легко ингибируются многими соединениями, включающими пиридазиноновые гербициды SAN 6706 и 9789, способствующими накапливанию фитоина.
Поскольку ново-синтезированный фитоин представлен цис-изомером, а все окрашенные каротиноиды имеют транс-конфигурацию, в процессе десатурации фитоина должна происходить изомеризация. Эксперименты, выполненные на хромопластах плодов перца однолетнего и томатов, а также на других источниках, свидетельствуют, что превращение цис-изомера в транс-изомер происходит на уровне фитофлуина.
В частности, хромопласты перца однолетнего и томатов содержали фитофлуин в цис- и в транс-конформации, в то время как все последующие соединения в цепи превращения фитоина посредством реакций десатурации представлены транс-изомерами, а транс-фитоин представлен только в следовых количествах (рис. 14). Таким образом, в процессе превращения фитоина в ликопин происходят четыре этапа десатурации с одновременным введением двойной связи и однократная изомеризация цис-изомера в транс-форму. 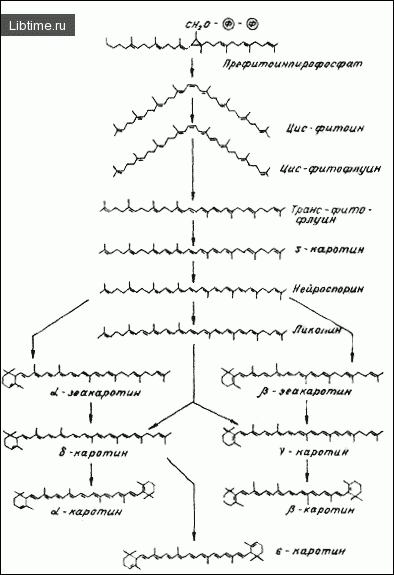
G.Britton предполагает существование ферментного комплекса, составляющего интегральную часть мембранной структуры, принимающего участие в реакциях десатурации. Из ацетоновых порошков пластид томатов была выделена и частично очищена с помощью фракционирования сульфатом аммония ферментная система, способная осуществлять превращение фитоина в ликопин.
Однако вопрос о составных компонентах этой системы еще не выяснен, имеются лишь предположения о существовании одной изомеразы, превращающей цис-изомер каротиноида в транс-форму. В мандариновой разновидности томатов вместо транс-каротинов накапливаются поли-цис-каротиноиды, такие, как проликопин и др. Цис-изомеры фитофлуина, f-каротина и нейроспорина были идентифицированы как вероятные промежуточные соединения в синтезе проликопина.
В то же время нормальные красные плоды и плоды мутантных растений с мандариновой окраской различаются между собой лишь по одному гену. Очевидно, что дефектный ген в мандариновой разновидности томатов кодирует изомеразу, которая недостаточно эффективно осуществляет изомеризацию цис-фитофлуина в транс-изомер. При этих условиях происходит десатурация циc-изомеров с образованием поли цис-каротиноидов.
Это должно предполагать достаточно широкую специ фичность десатураз, участвующих в превращении каротинов, поскольку они с высокой эффективностью вводят двойные связи не только в транс-, но и в цис-изомеры. В настоящее время не совсем ясно количество десатураз, участвующих в реакциях десатурации каротиноидов. Было показано, что превращение фитоина в фитофлуин зависит от НАДФ, тогда как реакции, ведущие от фитофлуина до ликопина, требуют ФАД и Мn2+.
По-видимому, существуют по крайней мере две десатуразы, участвующие в дегидрогенировании каротинов, причем в превращении фитоина в фитофлуин участвует отдельный фермент. Изолированные хромопласты перца однолетнего способствуют превра щению фитоина в ликопин без добавления НАДФ. На первый взгляд это противоречит ранее полученным результатам об участии НАДФ в реакциях десатурации каротинов.
Однако было показано, что в интактных хромопластах содержатся достаточно высокие количества эндогенного НАДФ (910 пикомоль на 1 мг белка), что не исключает возможности участия НАДФ в реакциях десатурации. Имеются также предположения, что в процессах переноса электронов при десатурации участвуют ионы металлов и цитохромы. Дальнейшие реакции синтеза каротиноидов связаны с циклизацией концевых групп.
Циклические каротиноиды с 'beta;-и е-кольцами (см. структурные формулы 'beta;- и е-каротинов) широко распространены в природе, в том числе в фотосинтезирующих органеллах и хромопластах высших растений. При определении в цепи биохимических превращений точек, в которых происходит циклизация каротиноидов, используют ингибитор гербицидной природы 2-(4-хлорфенилтио) триэтиламмоний хлористый и никотин.
Когда плоды перца однолетнего обрабатывали 2-(4-хлорфенилтио) триэтиламмонием хлористым, накапливался ликопии и в значительно меньшей степени нейроспорин, в то время как ('beta;-каротин и другие циклические каротиноиды исчезали, хотя этот гербицид не вызывал такого эффекта in vitro. Сходное действие на биосинтез и накопление каротиноидов in vivo и in vitro оказывает никотин.
Для преодоления противоречий, вызванных различными эффектами реагентов in vivo и in vitro, нейроспорин и ликопин, синтезированные микроорганизмом Phycornyces blakesleanus, инкубировали с хромопластами перца однолетнего. При этом оба предшественника трансформировались в )'beta;-каротин, причем ликопин трансформировался предпочтительнее по сравнению с нейроспорином. Продолжение: Синтез каротиноидов.