Новосинтезированная РНК
Показано, что хлоропластные рРНК и тРНК кодируются пластидным геномом и синтезируются внутри этих органелл. мРНК для синтезируемых внутри хлоропластов полипептидов также кодируются пластомом. Кроме того, отсутствуют сведения о поступлении каких-либо РНК из цитоплазмы в строму пластид.
Исходя из этого можно было предполагать, что обнаруженные в хромо- и амилопластах корнеплодов моркови РНК кодируются пластидным геномом и синтезируются внутри органелл. Для проверки данного предположения проводились исследования фракционного состава 3Н-РНК, синтезированной в системе изолированных пластид.
Электрофоретическое разделение меченой РНК амило- и хромопластов осуществляли в присутствии немеченой суммарной РНК листьев моркови, которая служила в качестве маркера и носителя. 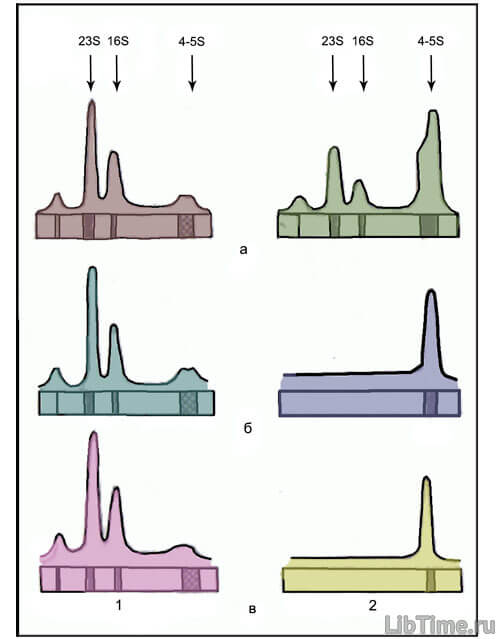
Как показал анализ профилей радиоактивности меченой РНК хромопластов формирующихся корнеплодов красной моркови, эти пластиды основное количество меченого предшественника включали в РНК, мигрирующую в области 23S и 16S рибосомных РНК.
Заметные уровни радиоактивности отмечались также в предрибосомной зоне и в области 4-5 S РНК. При увеличении времени инкубирования величина пиков радиоактивности возрастала, однако характер распределения метки при этом не изменился.
Сходные профили радиоактивности наблюдались при изучении новосинтезированной РНК хромопластов, выделенных из корнеплодов в середине и в конце вегетации (рис. 1).
Амилопласты формирующихся корнеплодов белой моркови (диаметр корнеплодов 3-5 мм) также основное количество метки включали в РНК, мигрирующие в области 23S и 16S рибосомных компонентов.
В предрибосомной зоне, как и в области 4-5S, также отмечались пики радиоактивности, однако они были значительно ниже по сравнению с пиками рибосомных 23S и 16S РНК.
В то же время амилопласты, выделенные из корнеплодов в середине вегетации (диаметр корнеплодов 8-10 мм), основное количество 3Н-УТФ включали в низко молекулярную РНК, тогда как в рибосомную и предрибосомную зоны включалось незначительное количество метки.
В конце вегетации (диаметр корнеплодов 16-20 мм) амилопласты теряли способность интенсивно включать меченый предшественник в РНК, вследствие чего идентификация компонентов новосиитезированной РНК на этой стадии развития растений затруднена.
Сравнивая положения пиков радиоактивности и пиков, соответствующих 23S и 16S компонентам суммарного препарата РНК листьев моркови, можно отметить, что новосинтезированные компоненты рибосомных РНК движутся при электрофорезе медленнее, чем молекулы 23S и 16S рРНК.
Это позволяет предположить, что новосинтезированные молекулы РНК являются предшественниками зрелых 23S и 16S хромо- и амилопластных (на первых этапах формирования корнеплодов белой моркови) рибосомных РНК.
Следует отметить, что новосинтезированные компоненты 23S и 16S рРНК хлоропластов также выявляются в виде предшественников с размерами, несколько превышающими зрелые молекулы 23S и 16S рРНК.
Более того, при исследовании фракционного состава новосиитезированной РНК хлоропластов водорослей и высших растений многими авторами отмечалось наличие общего предшественника для 23S и 16S РНК, мигрирующего в полиакриламидном геле медленнее, чем высокомолекулярные рибонуклеиновые кислоты пластидных рибосом.
По-видимому, обнаруживаемый нами в предрибосомной зоне пик обусловлен общим предшественником для 23S и 16S РНК хромопластов красной и формирующихся амилопластов корнеплодов белой моркови. Таким образом, нашими исследованиями, выполненными на пластидах корнеплодов моркови, установлено, что хромопласты содержат РНК, количество которой изменяется в зависимости от фазы развития растений.
Содержание РНК в хромопластах корнеплодов красной моркови в 2-3 раза выше, чем ДНК. В то же время оно заметно выше, чем в амилопластах корнеплодов белой моркови.
Хромопласты характеризуются высокой способностью к синтезу собственных рибонуклеиновых кислот в системе изолированных органелл, причем это зависит от фазы развития растений моркови. Основными фракциями хромопластной РНК, как и РНК хлоропластов высших растений и водорослей, являются рибосомные 23S и 16S, а также низкомолекулярные 4-5S РНК.
Фракционный состав РНК хромопластов существен но отличается от такового развитых амилопластов, суммарная РНК которых представлена низкомолекулярным компонентом, мигрирующим при электрофорезе в ПААГ в области 4-5S РНК и ранее обозначенной как 4.2S РНК.
Основными компонентами новосиитезированной РНК хромопластов также являются компоненты, мигрирующие в области 23S, 16S и 4-5S РНК. Результаты наших экспериментов дают основания полагать, что рибосомные 23S и 16S РНК хромопластов, как и в хлоропластах растений, синтезируются в виде предшественников, несколько превышающих по размеру зрелые молекулы 23S и 16S рРНК.
Кроме того, они указывают на возможность синтеза 23S и 16S рРНК в виде общего предшественника, мигрирующего в области между 23S рРНК и ДНК.


