Биосинтез белка
При электронно-микроскопическом изучении ультраструктуры хромопластов из растительных организмов после фиксации в растворах четырехокиси осмия наблюдался гранулярный материал, иногда называемый рибонуклео-протеидными, или рибосомоподобными, частицами.
Существует мнение, что гранулярный материал хромопластов, выявляемый после контрастирования уранилацетатом с последующей фиксацией четырехокисью свинца, представлен рибосомами. Авторы, которые называют гранулярный материал рибосомами, отмечают, что последние большей частью разбросаны по всей строме пластид и редко бывают сгруппированы в полисомы.
Однако именно полисомы являются центрами биосинтеза белка в биологических системах. Более того, даже данные о наличии рибосом в хромопластах какого-то определенного вида растений очень разноречивы. Так, например, S.Suzuki отмечает, что рибосомы в хромопластах перца однолетнего наблюдаются на всех этапах созревания плодов.
При этом в хромопластах полностью созревших плодов их количество заметно снижается по сравнению с более ранними этапами созревания. В то же время D.Simpson и др. указывают, что они не обнаруживали рибосом в хромопластах перца однолетнего ни на одной из исследованных стадий созревания плодов. Полученные нами результаты свидетельствовали, что хромопласты моркови содержат компоненты рибосомных РНК и характеризуются высокой РНК-синтезирующей активностью.
Это позволило предположить, что хромопласты способны синтезировать белки на собственной матрице. Для подтверждения этого проводились опыты по изучению биосинтеза белка в хромопластах. Параллельно проводили опыты по изучению белок-синтезирующей способности амилопластов белой моркови сорта Белая зеленоголовая.
Для изучения биосинтеза белка цито-плазматичеекими органеллами обычно используют два подхода: включение меченых аминокислот в белки цито-плазматических структур интактных организмов с применением ингибиторов трансляции - циклогексимида и хлорамфеникола, которые могут избирательно выключать белковый биосинтеза на пластидных рибосомах, и включение меченых аминокислот изолированными органеллами с последующим фракционированием белков и идентификацией радиоактивности в отдельных фракциях.
Поскольку нас интересовала только белок-синтезирующая способность хромо- и амилопластов без идентификации включения метки в отдельные белки, В. П, Лобов и И. А. Петров определяли общую радиоактивность суммарного кислото-нерастворимого материала пластид запасающих тканей корнеплодов красной и белой моркови после их инкубации в среде, содержащей меченую аминокислоту.
В настоящее время для изучения биосинтеза белка в хлоропластах наиболее часто используются бесклеточные системы, в которых источником энергии является АТФ, синтезированная интактными изолированными пластидами во время светоиндуцированной инкубации с мечеными аминокислотами. В таких системах энергией для биосинтеза белка обеспечиваются только хлоропласты, в то время как загрязняющие структуры, будучи лишенными источника энергии, не включают меченые аминокислоты в белок.
Однако в таких системах не удобно изучать синтез белка в запасающих пластидах, поскольку свет не индуцирует в них синтез АТФ. Поэтому мы применяли несколько модифицированную систему, разработанную для хлоропластов высших растений, в которой в качестве источника энергии используется экзогенная АТФ.
Результаты включения 14С-лейцина в кислотонерастворимый материал хромопластов формирующихся корнеплодов красной моркови показали, что эти пластиды способны включать значительные количества меченого предшественника. Включение метки в кислото-нерастворимый материал хромопластов, выделенных из корнеплодов в середине вегетации (диаметр корнеплодов 6-8 мм), увеличивалось почти в 1,5 раза.
При исследовании включения 14С-лейцина в хромопласты, выделенные в конце вегетации растений (диаметр корнеплодов 12-16 мм), отмечалось некоторое снижение радиоактивности кислото-нерастворимого материала этих органелл (табл. 1). Изолированные амилопласты формирующихся корнеплодов (диаметр 3-5 мм) белой моркови также включали значительные количества 14С-лейцина в кислото-нерастворимый материал.
Однако по мере увеличения размера корнеплодов в течение вегетации моркови белоксинтезирующая способность выделенных из них амилопластов резко снижалась. В середине вегетации (диаметр корнеплодов 8-10 мм) она была более чем в 10, а в конце вегетации (диаметр корнеплодов 16-20 мм) - более чем в 30 раз ниже, чем в амилопластах формирующихся корнеплодов. 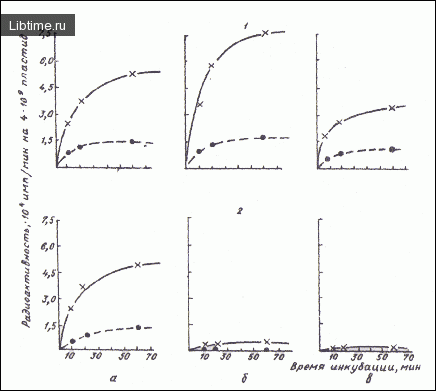
Включение 14С-лейцина изолированными хромо- и амилопластами значительно подавлялось хлорамфениколом. Известно, что хлорамфеникол - ингибитор белкового синтеза на рибосомах прокариотического типа. Он ингибирует биосинтеза белка в бактериях и хлоропластах и не подавляет включения меченого предшественника в белки, синтезированные на цито-плазматических рибосомах эукариот.
Следовательно, включение метки в кислото-нерастворимый материал обусловлено внутрипластидиым биосинтезом белка, а не возможной примесью цитонлазматических рибосом в препаратах пластид. По мере увеличения продолжительности инкубации интенсивность включения С-лейцина в кислото-нерастворимый материал амило- и хромопластов снижалась.
Это также свидетельствует о пластидном включении меченого предшественника, поскольку при сильном бактериальном загрязнении препаратов запасающих пластид отмечалась бы линейная зависимость включения 14С-лейцина от продолжительности инкубации. Таким образом, изучение включения 14С-лейцина в кислото-нерастворимый материал показало, что хромопласты моркови на протяжении всего периода развития корнеплодов, обладают высокой белок-синтезирующей способностью.
При этом отмечалась зависимость белок-синтезирующей способности хромопластов от стадии онтогенеза корнеплодов. Наиболее высокой способностью включать 14С-лейцин в белок характеризуются хромопласты, выделенные из моркови в середине вегетации корнеплодов.
Таблица 1 - Включение 14С-лейцина в белок в системе изолированных хромопластов корнеплодов красной моркови сорта Харьковская, Нантская и амилопластов корнеплодов белой моркови сорта Белая зеленоголовая, имп/мин на 4 * 108 пластид
| Возраст, дни после посева | Диаметр, мм | Вариант | Время инкубации, мин | ||
| 10 | 20 | 60 | |||
| 3-5 | Опыт | 26317 ± 4603 | 38224 ± 5937 | 52461 ± 9843 | |
| Контроль | 256 ± 49 | 342 ± 37 | 340 ± 59 | ||
| 6-8 | Опыт | 35004 ± 6365 | 59112 ± 10224 | 74843 ± 11034 | |
| Контроль | 288 ± 53 | 312 ± 42 | 307± 50 | ||
| 12-16 | Опыт | 17217 ± 5412 | 25333 ± 4898 | 35656 ± 8481 | |
| Контроль | 351 ± 48 | 330 ± 35 | 308 ± 84 | ||
| 3-5 | Опыт | 25197 ± 5472 | 35842 ± 6198 | 47417 ± 6881 | |
| Контроль | 249 ± 84 | 300 ± 51 | 307 ± 58 | ||
| 8-10 | Опыт | 1912 ± 371 | 2814 ± 494 | 3812 ± 783 | |
| Контроль | 252 ± 24 | 217 ± 44 | 268 ± 32 | ||
| 16-20 | Опыт | 924 ± 86 | 1232 ± 204 | 1423 ± 231 | |
| Контроль | 307 ± 12 | 292 ± 41 | 296 ± 23 | ||
Между стадией развития корнеплодов белой моркови и белок-синтезирующей способностью амилопластов также установлена зависимость. Причем для запасающих пластид белой моркови она носит более выраженный Характер по сравнению с зависимостью, установленной для хромопластов красной моркови.
Как и хромопласты, амилопласты формирующихся корнеплодов включают большие количества 14С-лейцина в белок пластид. Однако по мере увеличения размера корнеплодов включение метки в кислото-нерастворимый материал амилопластов резко снижается и в конце вегетации составляет всего 3 % исходного значения.
Высокая белок-синтезирующая способность хромопластов дает основания полагать, что наблюдаемый в хромопластах гранулярный материал представляет собой рибосомы. Следует отметить, что гранулярный материал, идентифицированный как рибосомы хромопластов, сходно с рибосомами хлоропластов фотосинтезирующих тканей, характеризуется несколько меньшими по сравнению с цитоплазматическими рибосомами размерами.
Литература: В. П. Лобов и И. А. Петров. "Хромопласты".


